2023年北京各区高三期中考试已经落下帷幕,为了更好的帮助同学们复盘考试情况,查缺补漏。北京高考在线为大家整理了2024高考化学盐类水解和沉淀溶解平衡知识点归纳!希望对大家高中化学答题及备考有帮助!
2024高考化学盐类水解和沉淀溶解平衡知识点归纳
考点1:盐类水解平衡及其应用
一 、盐类水解的定义和实质
1. 盐类水解的定义
强酸弱碱盐和强碱弱酸盐溶于水时,电离产生的阴离子或阳离子可分别与水电离出来的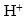 或
或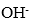 生成弱电解质—弱酸或弱碱。盐与水发生的这种作用叫做盐类的水解。
生成弱电解质—弱酸或弱碱。盐与水发生的这种作用叫做盐类的水解。
2. 盐类水解的实质
盐类的水解是盐跟水之间的化学反应,水解反应的实质是生成弱电解质使水的电离平衡被破坏而建立起新的电离平衡。
3. 盐类水解反应离子方程式的书写
一般盐类水解的程度很小,水解产物也很少,通常不生成沉淀和气体,书写水解方程式时,一般不用“↑”、“↓”。盐类水解是可逆反应,除发生强烈双水解的盐外,一般盐类水解的离子方程式中不写“=”而写“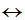 ”。
”。
二、盐类水解的影响因素及其应用
1. 内因:盐本身的性质
(1)弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
2. 外因
(1)温度:升高温度,水解平衡正向移动,水解程度增大。
(2)浓度:
① 增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大;加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
② 增大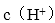 ,促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大
,促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大,促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
三、盐类水解的规律
有弱才水解,都弱都水解,越弱越水解,谁强显谁性。
1. 组成盐的弱碱阳离子能水解,相应盐溶液显酸性;组成盐的弱酸阴离子能水解,相应盐溶液显碱性。
2. 盐对应的酸(或碱)越弱,水解程度越大,相应盐溶液碱性(或酸)性越强。
3. 多元弱酸跟的正酸根离子比酸式酸根离子水解程度大得多,如同浓度的
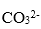 比
比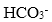 的水解程度大得多。
的水解程度大得多。
四、溶液中的几个守恒关系
1. 电荷守恒:电解质溶液呈电中性,即所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数代数和为零。
2. 物料守恒(原子守恒):即某种原子在变化过程(水解、电离)中数目不变。
3. 质子守恒:即在纯水中加入电解质,最后溶液中与其它微粒浓度之间的关系式(由电荷守恒及质子守恒推出)
考点2:沉淀溶解平衡
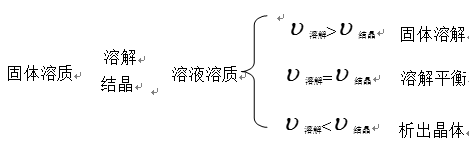
一、溶解平衡
溶质溶解的过程是一个可逆过程:
二、溶度积
1. 溶度积常数:一定温度下难溶电解质的饱和溶液中,各组分离子浓度幂的乘积为一常数。
与其他平衡常数一样,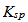 的大小只与温度有关。
的大小只与温度有关。
2. 某难溶电解质的溶液中任一情况下有关离子浓度幂的乘积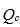 。
。
3. 溶度积规则

声明:本文由北京高考在线团队(微信公众号:bjgkzx)排版编辑,内容来源于网络,如有侵权,请及时联系管理员删除。




































